 6 大辅助牵引技术:让内镜下黏膜剥离术变得简单
6 大辅助牵引技术:让内镜下黏膜剥离术变得简单
内镜下黏膜剥离术(ESD)因其完整切除率高,安全性好,目前已成为广为接受的胃肠道早癌微创治疗术式。其基本术式分三步:即黏膜下注射,病变周围黏膜的环形切开和病变黏膜下组织的剥离。
对一些 ESD 治疗困难部位的病灶,通常采取反复的黏膜下注射,虽为后续剥离操作提供了有限的手术视野,但手术时间长,增加了出血、穿孔危险。另一种简单的方案是根据重力的方向尝试调整病人体位,使剥离面获得理想的张力,并提供良好操作视野,但病人可选择体位有限,限制了使用效果。
因此如何在术中取得良好「手术视野」,实现安全、精确切割和剥离操作的方法成为解决上述问题的关键。
受外科牵拉技术启发,各种内镜辅助牵引技术应运而生。按牵引力来源的部位可大致分为体内牵引和体外牵引;按牵引装置构成又可分为金属夹丝线联合牵引技术、金属夹弹力圈联合牵引技术、S-O 金属夹牵引技术、磁力锚技术等。
本文就当前出现的各种相关牵引技术的优、劣势进行综述,以期为临床抉择提供参考。
金属夹丝线联合牵引技术
目前应用为广泛的方法之一,在食管、胃、十二指肠和结肠手术中均有应用。其技术要点为:
1. 在体外将丝线结扎于金属夹双侧夹臂之间,通过内镜治疗通道,将金属夹固定夹闭在已切开边缘的病灶上(图 1a)。轻拉丝线用于保持适度张力,使得病灶被充分拎起,而后实施完整剥离。但因其牵引方向有限,难以向病变的对侧(肛侧)方向施力。
2. 后来有学者对上述方法做了改进,即在第一个金属夹的对侧黏膜壁上固定另一个金属夹,将结扎于第一个金属夹的丝线从此处绕过,产生类似 「滑轮组」效应,以期获得肛侧方向拉力(图 1b)。
3. 另外一种更直接的方式是,把第二枚金属夹与丝线同时固定于对侧黏膜上,使剥离组织产生来自对侧的张力,见图 1c。但此种方法仍存不足,一是丝线本身只能提供定向拉力;二是丝线本身没有收缩性,随着剥离面的加大,丝线的张力会减小,其作用会随之减弱或消失。

图 1 金属夹丝线联合牵引技术的不同变体(1a. 直接丝线牵引法;1b. 利用「滑轮组」效应的丝线牵引法;1c. 对侧丝线牵引法)
此方法原理较为简单,可操作性较好,材料也比较容易获得,丝线、尼龙线、牙线均可充当拉线材料。有随机对照研究显示,同传统 ESD 相比,其缩短了操作时间,也减少了黏膜下注射次数,但在操作过程中可能有金属夹脱落问题。
金属夹弹力圈联合牵引技术
金属夹弹力圈联合牵引技术为一种体内牵引技术,相对于拉线而言,弹力圈依靠自身的延伸即可在体内提供作用力。由于不需提供外力,可不受解剖位置和消化道管腔大小的限制,特别适用于 ESD 手术操作困难位置 。
该弹力圈所使用的材质已在临床广泛使用,如食管静脉曲线套扎器的 O 型圈、外科无菌手套等,其在体内性质稳定,不会产生过敏反应。
实际操作中,在体外以 3.0 丝线将医用弹力圈扎于金属夹一侧臂上,而后与金属夹一起收纳于释放器鞘内(图 2a);在体内完成预分离黏膜后,将金属夹固定于病灶边缘,第二个金属夹侧臂穿过弹力圈固定于病灶对侧边缘(图 2b-c);病灶表层黏膜遂因弹力作用外翻,暴露视野(图 2d)。
术后,辅助器械连标本回收。考虑到弹力圈要预收纳于鞘内,以及后期易操作性,此圈折叠和展开后的理想半径分为 2 mm 和 5 mm,结扎所用的丝线为红色,以便与手术背景产生对比。
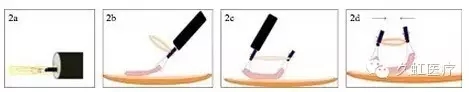
图 2 金属夹丝线联合牵引技术的流程图(2a. 金属夹和弹力圈在体外收纳于释放器鞘内;图 2b. 附有弹力圈的首枚金属夹夹闭于预分离黏膜上;图 2c. 第二枚金属夹穿过弹力圈固定于对侧分离黏膜;图 2d. 两枚金属夹依靠弹力作用翻起黏膜,暴露视野)
S-O 金属夹牵引技术
2009 年两位日本学者 Sakamoto 和 Osada 以弹簧、金属夹和尼龙圈为基础设计出另一种体内牵引技术,并以两人名字的首字母命名为 S-O 金属夹牵引技术。该方法由金属夹弹力圈联合牵引法衍变而来,以弹簧替代弹力圈,力求获得更大的伸缩性,来适应大的、表浅性的结肠早期肿瘤的 ESD 切除(图 3)。
本装置中的弹簧长度为 7 mm, 宽度为 1.8 mm,1 g 以上的力可使弹簧产生形变,伸展长度为 10 倍,可承拉力为 20 g。完成黏膜剥离后,用内镜剪剪开尼龙圈,随标本取出。临床前瞻性的对照研究显示,此方法实验组的手术时间、肿瘤整块切除率和安全性均优于对照组。

图 3 S-O 金属夹构成及牵拉模式图(3a. S-O 金属夹构造图;3b. S-O 金属夹牵拉模式图)
磁力锚牵引技术
依靠磁场产生的磁力为 ESD 操作提供不同角度、方向和大小的牵引力是一项非常有创造性的设想,将一块小磁铁捆绑于一个金属夹或两个金属夹之间的结扎线上,以单/双通道内镜将其固定既定位置后,在体外用另一块磁铁对其产生磁力,对整个剥离过程实施牵拉。
这项技术自发明以来,历经多次改进。磁铁种类可分为电磁铁、钐钴稀土永磁及钕稀土磁铁,而后者是目前磁力的磁性材料,包被于磁铁表面可防止人体组织对镍过敏。体外磁铁形状可为正方形、圆柱形或碟状,而体内磁铁则为易于捆扎的环形。磁铁的锚点可分为单锚点和双锚点,后者视野更开阔(图 4)。
需注意的是,由于磁铁之间磁力的产生大小通常与其体积和距离相关,在行胃体后壁 ESD 手术时,应加大体外和体内磁铁的体积或数量,但磁铁数量增加可能妨碍操作视野。
目前,磁力锚牵引技术的所应用的体外磁铁已配备制式可伸缩臂(日本 SFC Co Ltd 公司,FA-M-VC2)以减轻助手工作量,平台组装平均时间仅为 4 分钟,手术时间也较对照组缩短。但整个系统价格较贵,相关研究也仅限于在动物的胃中,亟待进一步研究证实。
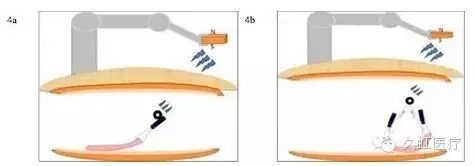
图 4 磁力锚牵引技术的不同变体(4a. 使用单锚点磁力锚牵引技术的流程图;4b. 使用双锚点磁力锚牵引技术的流程图,因形成三角形平面,磁铁处于顶点,故远离剥离面,能提供更广阔视野)
钳牵引技术
钳牵引技术作为一种体外牵引技术,有着自身优势:
1. 具备硬式材料的特性,即可对靶组织实施「拉」、「推」、「挑」以及「旋转」等其它牵引技术无法比拟的多种动作,达到牵引效果;
2. 可反复钳夹组织及更换牵拉点,达成术者和助手手术意向;
3. 撤收方便,并可帮助回收手术标本 。
临床操作中,实现该方法的第一步和首要步骤是将牵引钳在内镜引导下送入既定位置,采用单通道内镜时,可外附于镜身,以自制的鞘或另一把内置于活检孔道的钳子固定(图 5a-b)。如采用双通道内镜,则可通过其中一活检孔道送入实施牵拉,另一孔道送入电刀实施剥离操作(图 5c)。
目前已设计出专业内镜如 R-scope 满足这一需求,两个腔道内器械在把手和抬举器控制之下可分别做纵向及横向运动,另外镜身还具有多层折叠功能,极大的方便了手术操作。不足之处是,多孔道设计使镜身较粗(14.3 mm),不适合处理一些需大幅度反转镜身的病变。
此外,还可采用经皮经胃的方法置入牵拉钳(图 5d)。但因该方法使手术准备时间延长且创伤较大,增加了手术风险,目前仅处于动物实验阶段。

图 5 体内/外钳牵引技术应用原理图(5a. 采用自制鞘将钳身固定于镜身上,通常为镜下视野 12 点位;5b. 以另一预置于活检通道内的钳子固定牵引钳,送到预定位置后可撤收内置钳,更换手术器械进行手术操作;5c. 双活检通道内镜可在一条内镜下进行牵拉和手术操作,无须更换器械,缩短操作时间;5d. 体外经皮经胃法牵拉法示意图)
此外,一些学者尝试对牵拉钳进行改进,赋予其更多自调功能,其中的典型代表是 Anubiscope(德国 Karl Storz 公司),该内镜附件的直径为 3.7 mm,有一可调式的远端,通过其近端手柄的控制,可在垂直的 2 个方向做 100°弯曲,加之其旋转、拉及推功能,可程度发挥其牵拉效果。
机器人牵引技术
得益于机器视觉、机电一体化和人工智能技术的发展,可进行 ESD 操作的主从式经腔道内镜机器人(master and slave transluminal endoscopic robot, MASTER)已步入内镜领域并在多次的动物实验中均有良好表现。
MASTER 主要由三部分构成:控制端、远程工作站和工作端。其将传统的 ESD 的工作分为两部分,即一名医师操作控制端,双手负责内镜前端的器械操作,完成牵拉、切割、剥离等多种操作,另一名内镜医师仅负责控制镜身来完成整个手术,大大减轻了医生工作量。
此外,MASTER 所独有的触觉反馈功能可在无视野情况下感知有无组织接触,提高了操作的安全性。由于内镜机器人是人机交互系统,在处理手术中复杂和意外情况时,仍需传统内镜进行补充,因此还有很长的路要走。
笔者认为,在临床应用相关 ESD 牵拉技术时还需要注意以下几点:
1. 仍不能忽视重力和透明帽在 ESD 手术中的潜在牵引作用,尤其在深部肠道 ESD 手术中,因为易成袢的肠腔走形和较多的结肠皱襞使一些牵拉技术难以发挥优势。因此,要根据肠腔残留液体方向判断正确的体位(病变位于液体对侧时),以使剥离面在重力作用下获得理想的张力 。
早期由于剥离量较少,重力作用发挥不明显。此过程中可以利用透明帽的顶撑作用或在黏膜下层追加注液体垫的方式予以改善。 随着剥离量增多,重力作用凸显,视野逐渐清晰,术程随之加快。
2. 辅助牵引技术使用需要有充分的病例评估、手术预案和物质准备。病例上通常选择一些常规手术难以凑效病例,如解剖位置困难、病变纤维化。术前要制定好手术路径,相关人员要完善相关器材准备,以简单、省时、经济为原则。
3. 需要良好的团体协作,术者、助手、麻醉师要进行良好沟通,能及时应对术中的突发情况,限度减少手术风险。
综上,在临床应用相关 ESD 牵拉技术时,我们要充分把握其适应证,同时也期待更简捷、合理的平台及相应操作指南推出,为其普遍使用奠定基础。




